
Produits & Réglementation
Le saviez-vous ?
Nos ancêtres utilisaient-ils déjà des colorants dans leurs assiettes ?
Dès le Moyen-Age, l'homme utilise des colorants d'origine naturelle pour améliorer l'appétence d'aliments ou de plats. Le safran permettait d'obtenir du jaune, le curcuma donnait l'orange, le bois de santal donnait le rouge, le tournesol donnait du bleu ou du violet, le persil donnait le vert... ...
Les ingrédients santé
Les ingrédients santé répondent aux préoccupations de santé actuelles, telles que la santé cardiovasculaire, dentaire, digestive. Ils sont utilisés dans différents types de produits alimentaires, comme certaines céréales petit-déjeuner, l'alimentation pour les nourrissons et les enfants en bas âge, les sportifs ou encore les personnes souffrant de certaines pathologies ou suivant un régime alimentaire adapté. On les retrouve également sous forme de compléments alimentaires.
Il existe plusieurs familles d'ingrédients santé : ferments dits « probiotiques », fibres alimentaires, caroténoïdes, oméga 3, microalgues, protéines, vitamines et minéraux...
L'harmonisation européenne s'est peu à peu développée lorsqu'elle permettait de mieux protéger la santé des consommateurs tout en favorisant la libre circulation des marchandises au sein de l'Union européenne :
- En 1977 : première directive sur les aliments destinés à une alimentation particulière
- En 1997, le premier règlement sur les nouveaux aliments
- En 2002, la première directive sur les compléments alimentaires
- En 2006, publiés le même jour le règlement visant à l'harmonisation en termes d'adjonction de vitamines, minéraux et autres substances ainsi que le règlement sur les allégations nutritionnelles et de santé
Bien avant l'harmonisation réglementaire européenne, la France s'était dotée de règles pour encadrer l'utilisation des « ingrédients santé ». Elle a conservé certaines spécificités.
Utilisation des « ingrédients santé »
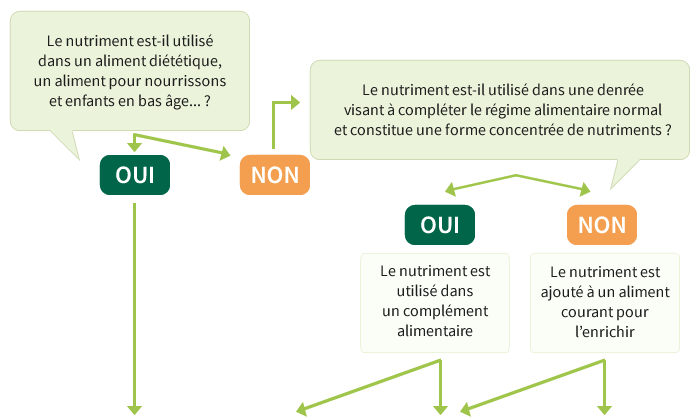
Les ingrédients santé peuvent être utilisés dans :
- les aliments de consommation courante pour les enrichir
- les compléments alimentaires
- les denrées alimentaires destinées aux nourrissons et aux enfants en bas âge, les denrées alimentaires destinées à des fins médicales spéciales et les substituts de la ration journalière totale pour contrôle du poids
Selon ces trois cas et selon le type de nutriments (vitamines, minéraux, autres substances), les règles à appliquer seront différentes.
En termes de communication sur les aliments vendus au consommateur, le règlement sur les allégations nutritionnelles et de santé s'applique à toutes ces catégories de produits.
• décret 2006-352 et ses arrêtés d'application Règles pour l'addition des autres substances dans les compléments alimentaires et les aliments courants : annexe III du règlement 1925/2006
• décret 2006-352 et ses arrêtés d'application Règles d'addition des vitamines et minéraux aux aliments courants :
• annexes I et II du règlement 1925/2006 Communication sur les ingrédients santé par l'utilisation d'allégations nutritionnelles et de santé :
règlement 1924/2006 et ses actes d'application
Utilisation des ingrédients santé dans l'alimentation destinée à répondre à des besoins spécifiques
Certaines catégories de denrées alimentaires sont indispensables pour répondre à des besoins nutritionnels de certains groupes vulnérables de la population. Ces catégories de denrées alimentaires comprennent les préparations pour nourrissons, les préparations de suite, les préparations à base de céréales et les denrées alimentaires pour bébés, ainsi que les denrées alimentaires destinées à des fins médicales spéciales et les substituts de la ration journalière totale pour le contrôle du poids.
Quelle est la réglementation applicable ?
Aujourd'hui la règlementation est en cours de révision.
Le règlement cadre est le
règlement 609/2013. Il s'applique pleinement depuis le 20 juillet 2016. Il remplace la directive cadre
2009/39 sur les denrées destinées à une alimentation particulière en supprimant la notion d'alimentation particulière au profit de la notion de groupes vulnérables. Il liste et définit les groupes de denrées alimentaires pour lesquelles des dispositions spécifiques sont fixées par des règlements dédiés. Il précise les conditions générales auxquelles doit répondre toute denrée alimentaire destinée à un groupe vulnérable de la population.
Les substances pouvant être ajoutées à ces catégories de denrées alimentaires figurent sur la liste de l'Union en annexe du
règlement 609/2013.
Les textes d'applications sont en cours d'adoption, ils établissent les exigences en matière de composition et d'information.
Deux textes ont déjà été publiés ; ils concernent :- les préparations pour nourrissons et les préparations de suite : règlement 2016/127, applicable de façon obligatoire à partir du 22 février 2020 sauf pour les préparations pour nourrissons et les préparations de suite à base d'hydrolysats de protéines pour lesquelles la date est repoussée au 22 février 2021 ;
- les denrées alimentaires destinées à des fins médicales spéciales : règlement 2016/128, applicable de façon obligatoire à partir du 22 février 2019, sauf pour les denrées alimentaires destinées à des fins médicales spéciales pour nourrissons, pour lesquelles la date est repoussée au 22 février 2020 ;
- les préparations à base de céréales et les denrées alimentaires pour bébés ;
- les substituts de la ration journalière totale pour le contrôle du poids.
Les aliments pour sportifs et les boissons à base de lait et produits similaires destinés aux enfants en bas âge ont été exclus de cette nouvelle réglementation ; ils ne sont plus considérés comme des aliments nécessitant des dispositions réglementaires spécifiques. La réglementation alimentaire s'applique donc à ses produits et notamment les règles sur l'adjonction de vitamines et minéraux et le règlement sur les allégations.
Adjonction de vitamines, minéraux et autres substances à but nutritionnel ou physiologique
Les vitamines, les minéraux et les autres substances à but nutritionnel et physiologique qui peuvent être utilisés dans les denrées destinées à des groupes vulnérables de la population sont précisés par la réglementation, tout comme leurs formes. Les listes sont arrêtées par catégorie de denrées.
Les fabricants doivent se conformer aux règles de composition essentielle et peuvent éventuellement ajouter de leur propre initiative des nutriments et autres substances énumérées, en tenant compte des limites maximales autorisées et des besoins spécifiques.
Quels sont les vitamines, minéraux et autres substances utilisables ?
Le règlement 609/2013 précise, en annexe, la liste et les formes de vitamines, minéraux, acides aminés et autres substances (carnitine et taurine, nucléotides, choline et inositol) qui peuvent être utilisées pour les différentes catégories :
• Préparations pour nourrissons et préparations de suite ;
• Préparations à base de céréales et denrées alimentaires pour bébés ;
• Denrées alimentaires destinées à des fins médicales spéciales ;
• Substituts de la ration journalière totale pour contrôle du poids.
Les teneurs de chaque nutriment sont indiquées dans les règlements ou directives qui spécifient les compositions essentielles c'est-à-dire les éléments indispensables pour répondre aux besoins spécifiques.
La liste des vitamines et minéraux peut-elle être modifiée ?
Il est possible de demander l'ajout d'une vitamine, d'un minéral, d'une substance ou d'une forme de vitamine ou de minéral à ces listes. Pour cela un dossier démontrant la sécurité du nutriment et sa biodisponibilité doit être présenté et évalué par l'Autorité européenne de sécurité des aliments (EFSA). Un guide administratif aide les opérateurs dans cette démarche.
Quelles quantités maximales de vitamines et minéraux peut-on ajouter ?
Les quantités minimales et maximales sont fixées par les textes spécifiques à chaque catégorie de denrées alimentaires destinées à un groupe vulnérable de la population : on les appelle les règles de composition essentielle.
Quelles sont les règles pour les préparations à base de céréales et denrées alimentaires pour bébés ?
Dans l'attente de la publication d'un règlement spécifique, la directive 2006/125 reste applicable.
Quelles sont les règles pour les denrées destinées au régime hypocalorique ?
Dans l'attente de la publication d'un règlement spécifique, la directive 96/8 reste applicable. L'annexe I comporte les règles de composition.
Quelles sont les règles pour les denrées alimentaires destinées à des fins médicales spéciales ?
Les denrées alimentaires destinées à des fins médicales spéciales sont une catégorie de denrées spécialement traitées ou formulées et répondant aux besoins nutritionnels des patients. Elles ne peuvent être utilisées que sous contrôle médical.
Elles constituent une alimentation exclusive ou partielle des patients dont les capacités d'absorption, de digestion, d'assimilation, de métabolisation ou d'excrétion des aliments ordinaires ou de certains de leurs ingrédients ou métabolites sont diminués, limités ou perturbés, ou dont l'état de santé détermine d'autres besoins nutritionnels particuliers qui ne pas peuvent être satisfaits par une modification du régime alimentaire normal.
Le texte applicable est le règlement 2016/128 qui remplace la
directive 99/21. Il s'appliquera de façon obligatoire à partir du 22 février 2019, sauf pour les denrées alimentaires destinées à des fins médicales spéciales pour nourrissons, pour lesquelles la date est repoussée au 22 février 2020.
Quel étiquetage ?
Les dispositions générales du règlement « information du consommateur » ( règlement 1169/2011) définissent les exigences en matière d'étiquetage pour l'ensemble des denrées alimentaires, elles s'appliquent aux denrées alimentaires destinées à répondre à un besoin spécifique.
Il existe en plus des règles spécifiques, notamment sur la dénomination de vente, précisées dans chaque directive règlement.
Adjonction de vitamines et minéraux dans les complémentaires alimentaires
L'utilisation de vitamines et minéraux sous forme de comprimés ou gélules a tout d'abord été restreinte au domaine des médicaments. On en trouvait pour lutter contre les carences ou déficiences. En 1991, ces médicaments n'ont plus été remboursés par la Sécurité sociale. Une nouvelle sorte de produits a fait son apparition : les compléments alimentaires. Ils étaient vendus uniquement dans les pharmacies puis également dans les grandes surfaces. Les compléments alimentaires sont désormais positionnés pour répondre aux déficiences mais également au bien-être, à la forme, à la beauté...
Quelle est la réglementation applicable à l'adjonction de vitamines et minéraux dans les compléments alimentaires ?
En 2002, l'utilisation des ingrédients santé dans les compléments alimentaires a été harmonisée au niveau européen, par la directive 2002/46. Son objectif est double : permettre le fonctionnement efficace du marché intérieur tout en assurant un niveau élevé de protection des consommateurs. Cette directive cadre définit un complément alimentaire et précise qu'ils sont une catégorie de denrées alimentaires ce qui implique que la réglementation alimentaire s'applique.
Quels sont les vitamines et minéraux qui peuvent être utilisés dans les compléments alimentaires ?
La directive 2002/46 précise que seuls les vitamines et minéraux normalement présents dans un régime alimentaire puissent entrer dans la composition d'un complément alimentaire. La liste des vitamines et minéraux autorisés dans la composition des compléments alimentaires est indiquée en annexe I, sous les formes énoncées en annexe II.
Quel texte transpose la directive européenne sur les compléments alimentaires ?
Toute directive européenne doit être transposée en droit national. Aussi en France, la directive sur les compléments alimentaires a été transposée en droit français en 2006 par un décret et ses arrêtés d'application. La transposition française est plus large que le champ de la directive européenne et couvre ainsi les plantes, fixe des teneurs maximales pour les vitamines et minéraux.
Le décret de 2006 ( décret n°2006-352) :
- Il fixe des limites maximales, en attendant la fixation de limites au niveau européen.
- Il inclut dans son champ les plantes, les extraits de plantes, les autres ingrédients et les substances pouvant être utilisées dans la fabrication des compléments alimentaires.
- Il prévoit la déclaration auprès de la DGCCRF de la mise sur le marché de nouveaux compléments alimentaires.
- Il prévoit une procédure de reconnaissance mutuelle pour les compléments alimentaires qui contiennent une substance non autorisée en France mais légalement utilisée dans un autre Etat membre.
L'arrêté du 9 mai 2006, modifié par les arrêtés du 14 et du 17 novembre 2006, concerne les nutriments qui peuvent être employés dans la fabrication des compléments alimentaires.
- Il liste les vitamines et minéraux autorisés (annexe I), ainsi que leurs formes (annexe II).
- Il précise les critères de pureté des vitamines et minéraux (article 2).
- Il fixe les doses journalières maximales pour les vitamines et les minéraux (annexe III) : l'utilisation des vitamines et minéraux ne doit pas conduire à un dépassement de ces doses, compte-tenu de la portion journalière de produit recommandé par le fabricant.
La liste des vitamines et minéraux peut-elle être modifiée ?
Il est possible de demander l'ajout d'une vitamine, d'un minéral, d'une forme de vitamine, ou d'une forme de minéral à ces listes. Pour cela un dossier démontrant la sécurité du nutriment et sa biodisponibilité doit être présenté et évalué par l'Autorité européenne de sécurité des aliments (EFSA). Un guide administratif aide les opérateurs dans cette démarche.
http://ec.europa.eu/food/food/labellingnutrition/nutritional/adm_guidance_safety_substances_en.pdf
Si la forme n'a pas été consommée de façon significative avant le 15 mai 1997, alors c'est un nouvel aliment (novel food). Elle doit être préalablement autorisée conformément aux dispositions du règlement « novel food » (règlement 258/1997). A titre d'exemple, une forme de vitamine K, la vitamine K2 a été autorisée.
Quels sont les critères de pureté applicables aux vitamines et minéraux ?
Pour assurer la protection des consommateurs, les vitamines et minéraux doivent respecter des critères de pureté recommandés par des organismes internationaux. Il peut s'agir de ceux de la pharmacopée européenne ou de toutes autres institutions reconnues.
Lorsque les formes sont par ailleurs autorisées en tant qu'additif alimentaire, ce sont les critères de pureté définis dans le
règlement 231/2012 sur les spécifications des additifs alimentaires qui s'appliquent.
En France,
l'arrêté du 9 mai 2006 pris en application du
décret de 2006 reprend en son article 2 les critères de pureté applicables aux vitamines et minéraux employés dans la fabrication des compléments alimentaires. En l'absence de critères recommandés par les organismes internationaux, des critères sur les métaux lourds sont inclus dans l'arrêté et doivent être respectés.
Quelles quantités maximales de vitamines et minéraux peut-on ajouter ?
La
directive 2002/46 prévoit l'établissement des quantités minimales et maximales qui peuvent être ajoutées aux compléments alimentaires. Avant de les établir, la Commission a publié en 2006 un document pour initier les réflexions.
http://ec.europa.eu/food/food/labellingnutrition/supplements/discus_paper_amount_vitamins.pdf
Les quantités maximales, qui ne sont pas encore fixées tiendront compte des limites d'apport maximal tolérable, des autres sources alimentaires et des apports nutritionnels conseillés (ANC) lorsque la marge de sécurité est faible entre la limite maximale d'apport tolérable et ANC.
Le décret de 2006, dans un objectif de protection du consommateur, va plus loin que la directive puisqu'il fixe des limites maximales, en attendant la fixation de limites au niveau européen.
Quel étiquetage ?
Les dispositions générales du règlement information du consommateur ( règlement 1169/2011) définissent les exigences en matière d'étiquetage pour l'ensemble des denrées alimentaires, elles s'appliquent aux compléments alimentaires.
De plus, des indications spécifiques à cette catégorie de denrées doivent être mentionnées dans l'étiquetage, comme le fait que les compléments alimentaires ne remplacent pas une alimentation variée et équilibrée et qu'ils doivent être tenus hors de portée des enfants.
Adjonction d'autres substances dans les complémentaires alimentaires et en alimentation courante.
En 2006, les règles d'utilisation des substances à but nutritionnel ou physiologique et des ingrédients les contenant dans les compléments alimentaires et aliments courant sont harmonisées au niveau européen, par le règlement 1925/2006.
Son objectif est double : permettre le fonctionnement efficace du marché intérieur et assurer un niveau élevé de protection des consommateurs.
Qu'entend-t-on par « substance à but nutritionnel et/ou physiologique » ?
Les substances sont définies dans le chapitre III du règlement 1925/2006 comme ayant un effet nutritionnel ou physiologique autre que les vitamines et minéraux. Ces substances sont celles utilisées soit dans l'alimentation courante soit dans les compléments alimentaires. Le règlement couvre également les ingrédients apportant les substances.
Quelle est la procédure pour interdire ou restreindre l'utilisation d'une substance ?
Le règlement précise la procédure permettant à la Commission d'interdire une substance ou d'en restreindre l'utilisation. En cas de doute sur la sécurité de l'utilisation d'une substance ou d'un ingrédient contenant cette substance, une évaluation scientifique est réalisée par l'EFSA sur la base des informations communiquées par les Etats membres ou la Commission. Selon la conclusion de l'EFSA, la Commission peut inscrire la substance ou l'ingrédient la contenant :
- Dans une liste négative : la substance est interdite. A ce jour, seules sont inscrites les espèces d'Ephedra et leurs préparations
- Dans une liste restreinte. A ce jour aucune substance n'est inscrite
- Dans une liste sous contrôle communautaire. La liste des substances sous contrôle communautaire a un statut un peu spécial puisqu'il s'agit des substances pour lesquelles les données sont insuffisantes pour trancher quant à leur utilisation ou à leur interdiction et pour lesquelles des données scientifiques complémentaires sont demandées. A ce jour seul est inscrit le Pausinystalia yohimbe (K.Schum) Pierre ex Beille.
Les produits en contenant peuvent continuer à être mis sur le marché mais les opérateurs doivent fournir un dossier dans les 18 mois suivant l'ajout de la substance à la liste. A l'issue de l'évaluation par l'EFSA, la Commission européenne décide, dans un délai de 4 ans, soit d'autoriser de manière générale l'utilisation de cette substance soit de l'inscrire dans la liste négative ou dans la liste restreinte.
Quelle est la procédure française pour pouvoir utiliser une substance dans un aliment ?
Le
règlement 1925/2006 s'applique bien sûr aux opérateurs français. Mais étant donné qu'il ne couvre pas l'intégralité de ce qui était couvert par la législation française avant 2006, la France a souhaité conserver un texte spécifique complémentaire du règlement européen.
Le texte réglementaire applicable est un décret de 2006 (décret n°2006-1264 du 16 octobre 2006) sur les vitamines, substances minérales et autres substances employées dans la fabrication des denrées alimentaires.
Il prévoit :
- Une procédure de reconnaissance mutuelle pour les aliments qui contiennent une substance non autorisée en France et légalement utilisée dans un autre Etat membre.
- Une procédure d'autorisation pour une substance qui ne serait pas un novel food
- Un arrêté fixant les substances. A ce jour aucune demande n'ayant été déposée, aucun arrêté n'a été publié.
Quelle est la procédure française pour pouvoir utiliser une substance dans un complément alimentaire ?
En France, le décret « compléments alimentaires » (décret n°2006-352) inclut dans son champ d'application les plantes, les extraits de plantes, les autres ingrédients et les substances pouvant être utilisées dans la fabrication des compléments alimentaires. En France, le terme « substance » signifie, dans ce cas, « les substances chimiquement définies », et leurs préparations.
Il prévoit une procédure de reconnaissance mutuelle pour les compléments alimentaires qui contiennent une substance non autorisée en France mais légalement utilisée dans un autre Etat membre. Les substances contenues dans les compléments alimentaires ayant bénéficié d'une telle autorisation doivent être intégrées dans une liste. Cette liste est publiée sous forme d'un arrêté depuis 2016. Cet arrêté « substances » (arrêté du 26 septembre 2016) précise les conditions générales d'utilisation des substances et leurs spécifications.
Par ailleurs, il est aussi possible de déposer un dossier directement auprès des Autorités françaises. Le dossier est évalué par l'ANSES. Puis la DGCCRF informe l'opérateur de la décision prise par le Ministre.
Il est prévu qu'un arrêté liste les substances autorisées selon cette procédure.
Quelle est la procédure française pour pouvoir utiliser un extrait de plante dans un complément alimentaire ?
En France, le décret « compléments alimentaires » (décret n°2006-352) inclut dans son champ d'application les plantes, les extraits de plantes, les autres ingrédients et les substances pouvant être utilisées dans la fabrication des compléments alimentaires.
Il prévoit une procédure de reconnaissance mutuelle pour les compléments alimentaires qui contiennent une plante non autorisée en France mais légalement utilisée dans un autre Etat membre. Les plantes contenues dans les compléments alimentaires ayant bénéficié d'une telle autorisation doivent être intégrées dans une liste, qui précise les conditions d'utilisation et les restrictions d'emploi. L'arrêté « plantes et préparations de plantes » (arrêté du 24 juin 2014) contient cette liste des plantes et parties de plantes utilisables dans les compléments alimentaires. A l'annexe I figurent les plantes et les restrictions et, aux annexes II et III, figurent les conditions générales d'emploi : détention d'un dossier démontrant la qualité de la préparation et, si nécessaire, un dossier démontrant l'innocuité.
Les champignons ne sont pas concernés, car ils feront l'objet d'un arrêté, ultérieurement.
Un
guide d'application de l'arrêté « plantes » a été élaboré par la DGCCRF. Ce guide, non prescriptif, a pour objectif d'apporter des réponses concrètes aux interrogations techniques soulevées par l'arrêté. Il est prévu qu'il soit mis à jour régulièrement. A noter : il précise que certains extraits de plante sont à considérer comme des substances.
Par ailleurs, si l'extrait de plante répond à la définition du « novel food », un dossier de demande d'autorisation de l'extrait de plante, dans le cadre de ce règlement, doit être déposé.
Adjonction de vitamines et minéraux en alimentation courante
Avant 2006, des divergences de législations nationales ont conduit à des entraves à la libre circulation des marchandises au sein de l'Union européenne, un de ses piliers fondateurs. Ainsi, des aliments légalement fabriqués dans un Etat membre ne pouvaient être vendus dans un autre.
En 2006, ces règles sont harmonisées au niveau européen, par le règlement 1925/2006 relatif à l'adjonction de vitamines et minéraux et de certaines autres substances aux denrées alimentaires.
Son objectif est double : permettre le fonctionnement efficace du marché intérieur et assurer un niveau élevé de protection des consommateurs.
Quelles sont les conditions à respecter pour enrichir un aliment en vitamines et/ou minéraux ?
Le chapitre II du règlement 1925/2006 précise les dispositions concernant l'adjonction de vitamines et minéraux aux aliments.
Il est possible d'enrichir les aliments pour palier une carence dans la population ou dans des sous-groupes de la population, pour améliorer l'état nutritionnel de la population ou pour tenir compte de l'évolution des connaissances scientifiques concernant les vitamines et minéraux. L'adjonction peut se faire indépendamment de leur présence dans l'aliment.
Seules les formes autorisées et énumérées à l'annexe II peuvent être utilisées. Elles doivent être biodisponibles, c'est-à-dire utilisables par l'organisme. La levure enrichie en sélénium est, par exemple, une forme autorisée du sélénium.
Où trouver les listes de vitamines et minéraux autorisées en alimentation courante ?
Le règlement européen de 2006 ( règlement 1925/2006) fixe :
- la liste des vitamines et des minéraux qui peuvent être ajoutés aux denrées alimentaires (annexe I).
- les formes de vitamines et de minéraux qui peuvent être utilisées (annexe II).
La liste des vitamines et minéraux peut-elle être modifiée ?
Il est possible de demander l'ajout d'une vitamine, d'un minéral, d'une forme de vitamine, ou d'une forme de minéral à ces listes. Pour cela, un dossier démontrant la sécurité du nutriment et sa biodisponibilité doit être présenté et évalué par l'Autorité européenne de sécurité des aliments (EFSA). Un guide administratif aide les opérateurs dans cette démarche.
http://ec.europa.eu/food/food/labellingnutrition/nutritional/adm_guidance_safety_substances_en.pdf
Si la forme n'a pas été consommée de façon significative avant le 15 mai 1997, alors elle est considérée comme un nouvel aliment (novel food). Elle doit donc être préalablement autorisée conformément aux dispositions du règlement novel food (règlement 258/1997). A titre d'exemple, une nouvelle forme de vitamine K, la vitamine K2 a été autorisée.
Tous les aliments peuvent-ils être enrichis en vitamines et minéraux ?
Le règlement interdit l'ajout de vitamines et minéraux dans :
- les denrées alimentaires non transformées comme les fruits, légumes, viande, volaille, poisson
- les boissons de plus de 1,2 % en volume d'alcool
En dehors de ces catégories spécifiques, l'adjonction est autorisée que le nutriment soit naturellement présent ou non.
Quels sont les critères de pureté applicables aux vitamines et minéraux ?
Pour assurer la protection des consommateurs, les vitamines et minéraux doivent respecter des critères de pureté recommandés par des organismes internationaux. Il peut s'agir de ceux de la pharmacopée européenne ou de toutes autres institutions reconnues. Certaines formes de vitamines et minéraux sont par ailleurs autorisées en tant qu'additifs alimentaires. Dans ce cas, les paramètres définis dans le règlement 231/2012 relatif aux spécifications pour les additifs alimentaires s'appliquent également lorsque ces formes sont utilisées pour leurs propriétés de vitamines et minéraux.
Quelles quantités maximales de vitamines et minéraux peut-on ajouter ?
Le règlement prévoyait de fixer des quantités maximales d'adjonction, en tenant compte :
- des limites supérieures de sécurité ou limite d'apport maximum tolérable établies pour les vitamines et les minéraux
- des apports venant d'autres sources alimentaires
- des apports de référence pour la population
De plus lorsque les apports de référence pour la population sont proches des limites supérieures de sécurité, il sera également tenu compte de :
- la contribution des différents produits au régime alimentaire global de la population en général ou de sous-groupes de la population
- du profil nutritionnel de l'aliment qui devait être établi en application du règlement sur les allégations nutritionnelles et de santé ( règlement 1924/2006)
A ce jour, de telles limites n'ont pas été fixées.
Quelles quantités minimales de vitamines et minéraux peut-on ajouter ?
En ce qui concerne les quantités minimales pour les vitamines et minéraux ajoutées à l'alimentation courante, il faut se référer aux règles de l'étiquetage nutritionnel définies dans le règlement information du consommateur ( règlement 1169/2011) :
- 15% des apports de référence pour 100g ou 100ml pour les produits autres que les boissons
- 7,5% des apports de référence pour 100g ou 100ml pour les boissons
- 15% de l'apport de référence par portion si l'emballage ne contient qu'une seule portion.
Les apports de référence sont fixés à l'annexe XIII de ce règlement.
Tableau 1 : apports de référence
VITAMINES |
MINERAUX |
| Vitamine A (μg) 800 |
Chlorure (mg) 800 |
| Vitamine D (μg) 5 |
Calcium (mg) 800 |
| Vitamine E (mg) 12 |
Phosphore (mg) 700 |
| Vitamine K (μg) 75 |
Magnésium (mg) 375 |
| Vitamine C (mg) 80 |
Fer (mg) 14 |
| Thiamine (mg) 1,1 |
Zinc (mg) 10 |
| Riboflavine (mg) 1,4 |
Cuivre (mg) 1 |
| Niacine (mg) 16 |
Manganèse (mg) 2 |
| Vitamine B6 (mg) 1,4 |
Fluorure (mg) 3,5 |
| Acide folique (μg) 200 |
Sélénium (μg) 55 |
| Vitamine B12 (μg) 2,5 |
Chrome (μg) 40 |
| Biotine (μg) 50 |
Molybdène (μg) 50 |
| Acide pantothénique (mg) 6 |
Iode (μg) 150 |
| Potassium (mg) 2 000 |
Quel étiquetage ?
L'étiquetage nutritionnel a toujours été obligatoire en cas d'ajout de vitamines et minéraux. Il peut comporter une allégation relative à l'ajout dans les conditions fixées par le règlement 1924/2006. Deux allégations nutritionnelles sont possibles en fonction des quantités présentes : « source de » et « riche en » ainsi que toutes mentions similaires.
Qu'est-ce qu'une allégation ?
Une allégation est un message ou représentation facultative quel qu'en soit la forme, qui affirme, suggère, ou implique qu'une denrée alimentaire possède des caractéristiques particulières : apporter un bénéfice pour la santé du consommateur.
Même un symbole, un dessin ou une image peut constituer une allégation.
Comment communiquer sur les ingrédients santé ?
Les informations faisant un lien entre les ingrédients et la santé s'appellent des allégations. Elles sont strictement encadrées par un règlement européen ( règlement1924/2006). Pour être mentionnées sur l'étiquetage ou dans la publicité, les allégations doivent être autorisées sur la base d'un dossier scientifique. Elles doivent être utilisées en conformité avec le règlement, notamment inclure une mention sur l'importance d'une alimentation équilibrée et d'un mode de vie sain. Les allégations faisant référence à la prévention ou à la guérison d'une maladie sont strictement interdites.
Quelles sont les catégories d'allégations autorisées ?
Quatre types d'allégations sont autorisés :
- les allégations nutritionnelles renseignent sur le contenu des aliments (ex : riche en Oméga3, source de fibres,...)
- les allégations de santé décrivent le rôle des ingrédients sur une fonction de l'organisme. Elles sont soit génériques (ex : le calcium est nécessaire au maintien d'une ossature normale) soit innovantes et basées sur de nouvelles données scientifiques
- les allégations portant sur la diminution d'un facteur de risque de maladie (ex : le bêta-glucane d'avoine réduit le cholestérol, facteur de risque de développement de maladie cardio-vasculaire)
- les allégations portant sur la santé et le développement de l'enfant (ex : le DHA contribue au développement visuel de l'enfant jusqu'au 12 mois, le fer contribue au développement cognitif normal de l'enfant)
Depuis fin 2012, la communication sur les bénéfices santé des produits alimentaires a fortement évolué, conformément aux règles européennes.
Chaque année de nouvelles allégations de santé peuvent être autorisées par les Autorités européennes sur la base d'un avis scientifique de l'EFSA et en tenant compte éventuellement d'autres facteurs légitimes comme les politiques de santé publique. Ainsi, certaines allégations, bien qu'ayant reçues un avis positif de l'EFSA, ne sont pas autorisées.
Existe-t-il une liste des allégations ?
La Commission européenne tient à jour un registre des allégations.
On y trouve les allégations autorisées et les allégations rejetées.
Est-ce que la consommation des ingrédients de santé est surveillée ?
Depuis 2009, la France a mis en place la nutrivigilance. Ce dispositif national permet aux professionnels de santé de signaler tout effet indésirable qui pourrait, le cas échéant, être lié à une denrée contenant un ingrédient santé. Les cas reportés sont ensuite expertisés pour vérifier si le lien entre l'effet reporté et l'aliment est avéré ou non. La nutrivigilance apporte une sécurité complémentaire. C'est grâce à ce dispositif que l'Anses, Agence nationale de sécurité sanitaire de l'alimentation, de l'environnement et du travail, a mis en garde les parents contre l'utilisation exclusive de boisson instantanée aux amandes en remplacement de l'allaitement ou des laits infantiles.
Un des éléments important de l'étiquetage est la validité des valeurs nutritionnelles qui y sont indiquées. Ces valeurs doivent être représentatives de la réalité du contenu en nutriments.
La Commission européenne a publié un guide pour que les Etats membres puissent avoir une manière commune de réaliser les contrôles. Ce document est donc important pour les opérateurs. Il fixe des valeurs en fonction du type de produits, de la présence d'allégations...
